Die Bremse des Immunsystems
| 18. März 2010Was haben ein Fahrrad und das Immunsystem gemeinsam? Pedale und Bremse - im übertragenen Sinn: Denn wie beim Radfahren muss auch das Immunsystem "angekurbelt" werden, damit es sich bewegt - aber auch wieder "gebremst", wenn das gewünschte Ziel erreicht ist. Wie dieser "Bremsvorgang" auf molekularer Ebene im Detail vonstatten geht, untersucht eine neue Forschungsplattform am Zentrum für Molekulare Biologie und an der Fakultät für Chemie.
"Wenn man in die Pedale tritt, dann bewegt sich das Fahrrad. Hört man damit auf, wird das Rad zwar immer langsamer, aber es dauert noch eine Weile, bis es völlig zum Stillstand kommt. Soll es hingegen sofort stehen bleiben, muss man bremsen", erklärt Pavel Kovarik vom Department für Mikrobiologie, Immunbiologie und Genetik. Für die Immunreaktion des Körpers gelte das gleiche Prinzip: "Sie muss bei Gefahr - etwa einer Infektion - in Bewegung gebracht, sprich aktiviert werden. Es ist aber ebenso notwendig, dass die Immunantwort wieder gestoppt wird, sobald - oder sogar noch bevor - der Krankheitserreger wieder weg ist."
Denn wird zu spät "gebremst", kann das übel enden - schlimmstenfalls mit einem septischen Schock. Der ist die Folge einer Überreaktion des Immunsystems und kann sogar zum Tod führen. "Das Beispiel zeigt, wie wichtig es ist, dass unser Immunsystem perfekt gesteuert und reguliert wird - sowohl in der Phase der Aktivierung als auch in der Phase der Deaktivierung", verdeutlicht Kovarik.
Kleines Protein mit großem Namen
In einer neuen universitären Forschungsplattform, die der Biochemiker gemeinsam mit dem Physiker Ivo Hofacker vom Institut für Theoretische Chemie leitet, soll nun ein Molekül genauer unter die Lupe genommen werden, das vor allem beim "Bremsen" der Immunreaktion eine wesentliche Rolle spielt: ein kleines Protein mit dem sperrigen Namen Tristetraprolin, kurz TTP. Dieses ist am sorgfältig getimten Abbau von ganz bestimmten Botenstoffen, der sogenannten "messenger RNA (mRNA)", beteiligt:
"Das sind jene Moleküle, die die Information vom Pathogen-Befall überhaupt erst zu den Ribosomen bringen - dem Ort in der Zelle, wo die Proteine gebildet werden, die schließlich die entsprechende Immunreaktion auslösen.
"Stabilität der Boten-RNA zentral
Auch das kann der Professor am Beispiel des Radfahrens genauer erklären: "Wenn man schon in die Pedale tritt, also in Bewegung ist, kann man viel leichter beschleunigen als aus dem Stillstand heraus."
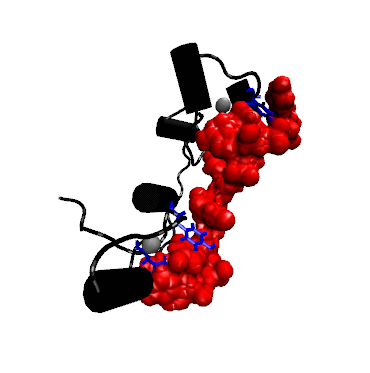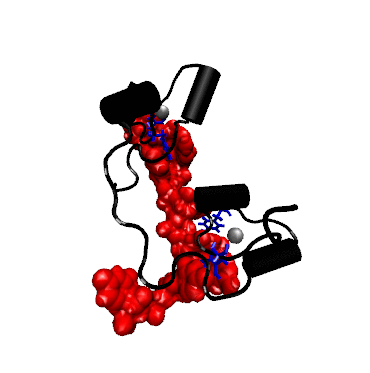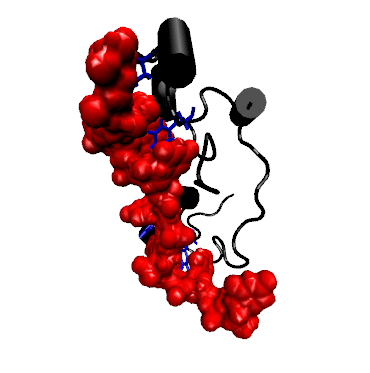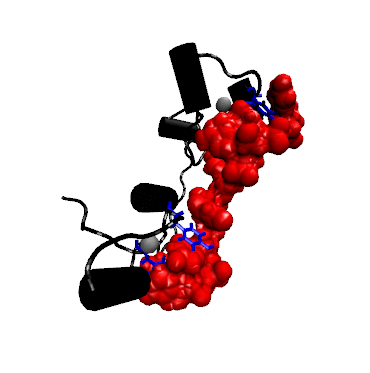
Struktur der Bindung zwischen dem RNA-bindenden Teil (dem sog. Zink-Finger) eines TTP-verwandten Proteins mit mRNA (rot).
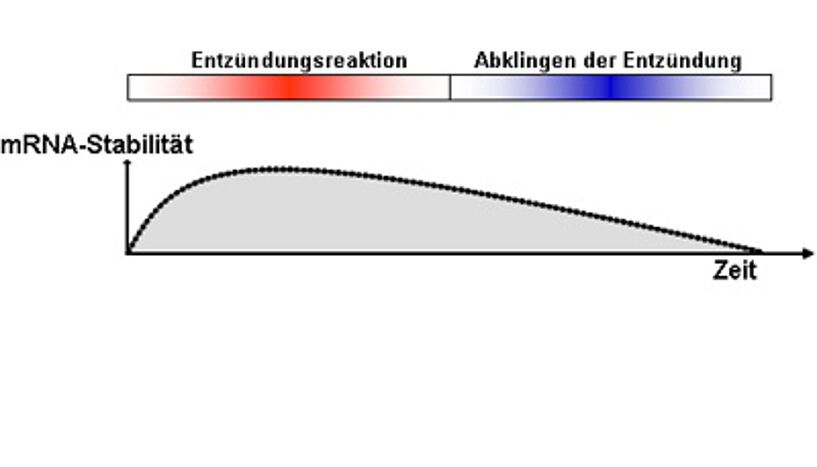
Auch das Immunsystem ist so ausgelegt, dass ununterbrochen eine bestimmte Menge an Boten-RNA gebildet wird. Diese ist aber nicht sehr stabil und wird, wenn keine Infektion oder Information da ist, schnell wieder abgebaut.
"Kommt jedoch ein Stimulus, wird die mRNA rasch stabilisiert. Die Zelle kann sofort reagieren und die Information in die entsprechenden Proteine umschreiben."
Ist die Information - also der Krankheitserreger oder die Infektion - wieder weg, müssen die Boten-Moleküle genauso schnell wieder destabilisiert werden. "Jetzt sind wir schon beim eigentlichen Thema: Es geht nicht immer darum, wie viele Boten-Moleküle eines Gens erzeugt werden, sondern es spielt eine große Rolle, wie lange sie in der Zelle bleiben. Also wie stabil die mRNA ist", betont Kovarik: "Die Stabilität der mRNA wird durch sogenannte AU-reiche-Sequenzen (ARE) gesteuert. Regulatorische Proteine erkennen diese Sequenzen, binden daran und wirken dann entweder stabilisierend oder destabilisierend. Tristetraprolin ist wie gesagt eines jener Proteine, das die Boten-RNA destabilisiert, also zu ihrem Abbau führt."
"Bremsvorgang" besser verstehen
Der Forscher will im Projekt vor allem ein Rätsel lösen: wie TTP die richtige Boten-RNA überhaupt erkennt. "Offensichtlich ist es nicht nur die Sequenz, die dabei als Erkennungssignal dient, sondern auch die Struktur bzw. die Faltung der mRNA", vermutet er.Ziel der interdisziplinären Plattform ist es, die wichtigsten Eigenschaften der Bindung von Tristetraprolin an die Boten-RNA zu verstehen - und zwar in ihrer Gesamtheit. "Das bedeutet, dass wir die Rolle von TTP beim Abbau der mRNA in einem genomweiten Ansatz analysieren werden."
Dabei ergänzen sich die beiden Projektgruppen am Department für Mikrobiologie, Immunbiologie und Genetik und am Institut für Theoretische Chemie ideal: "Wir führen die praktischen Experimente durch, Kollege Hofacker und sein Team analysieren die Daten bioinformatisch, sprich computergestützt", so Kovarik: "Gemeinsam etablieren wir die interdisziplinäre Forschung in diesem Bereich am Standort Universität Wien und nähern uns Schritt für Schritt dem Ziel, die 'Bremse des Immunsystems' besser zu verstehen." (br)
Die interdisziplinäre Forschungsplattform "Structural and Functional Analysis of mRNA Molecules Targeted by the RNA-binding Protein Tristetraprolin" ist eine Kooperation des Zentrums für Molekulare Biologie und der Fakultät für Chemie. Das dreijährige Forschungsvorhaben wird von Ao. Univ.-Prof. Mag. Dr. Pavel Kovarik vom Department für Mikrobiologie, Immunbiologie und Genetik (Leiter) und Ao. Univ.-Prof. Dipl.-Phys. Dr. Ivo Hofacker vom Institut für Theoretische Chemie (stv. Leiter) und den Dissertanten Mag. Franz Kratochvill und Mag. Andreas Gruber durchgeführt.